Química: Ligações Químicas
- alando

- 14 de jun. de 2021
- 5 min de leitura
Atualizado: 13 de jan. de 2022
Ligações Químicas
• Iônica:
→metal + ametal
→metal + H
→metal + semimetal
• Covalente:
→ametal + ametal
→ametal + H
→ametal + semimetal
• Metálica: entre metal + metal
• Átomos se ligam para alcançar estabilidade química.
• Regra do Octeto: Todos os átomos devem conter 8 em sua camada de valência, com exceção de H (2), Bl (4) e B (6).

Ligação Iônica
• O metal doa elétrons para o outro elemento químico. Para começar precisamos saber quantos elétrons cada elemento possui em sua camada de valência.
• Indique a fórmula eletrônica e a forma molecular do composto formado por um elemento A, um metal alcalino, quando unido ao elemento B (grupo 17).
→B = 7A = ametal
→A = metal alcalino = 1A
→Fórmula molecular = AB e fórmula eletrônica.

• Indique a fórmula eletrônica e a fórmula molecular do composto formado por um elemento A, do grupo 1A, quando unido a B, de nº atômico 16.
→B = 16 → 1s2 +2s2 + 2p6 + 3s2 + 3p4 → 6 elétrons na camada de valência (3).
→Cargas:
- B = Família 6A = carga é -2.
- A = Família 1A = carga +1.

→Fórmula eletrônica =

• Propriedades de compostos iônicos: Sólidos em condições ambientes; altas temperaturas de fusão e ebulição; bons condutores de eletricidade em água.
Ligação Covalente
• Não ocorre a doação e recebimento de elétrons, mas sim o compartilhamento
• Qual a forma molecular resultante da combinação entre um elemento químico A (calcogênio = 6A), com o elemento químico Boro (Família 3A; precisa de 6 para ficar estável)?

• Fórmula molecular da combinação de um elemento família 5A e H? PH3

• 2 elementos da família 5A: A≡B (ligação tripla).
• H com elemento 7A: H - X (ligação simples).
• Propriedades de compostos covalentes:
→Não possuem íons
→baixa condução de corrente elétrica, exceto em água.
→podem ser sólidos líquidos ou gasosos.
→baixas temperaturas de fusão e de ebulição, devido a fracas interações (não resistem ao calor).
→insolúveis em água.
Ligação Metálica
• Ocorre em formação de nuvens eletrônicas = circulação de elétrons.
• Liga Metálica: É formada pela junção de átomos metálicos; passa um p/ outro.
• Propriedades: boa condutibilidade elétrica e térmica; altos pontos de fusão e ebulição; maleabilidade e ductibilidade (grau de deformação que um material suporta até o momento de sua fratura); resistência à tração; reação espontânea com a água; brilho metálico.
Geometria Molecular
• F O N Cl I Br S C P H Se At
→Macete: Fui Ontem No Clubinho I Briguei Sai Correndo Pro Hospital Sentido AlmiranteTamandare)
• Nuvem: um elemento químico ou um par de elétrons livres que está no centro da molécula
→CH4: 4 nuvens e 4 ligantes = polaridade da molécula é apolar
→NH3: 4 nuvens (1 par de elétrons livres no centro + 3 elementos) e 3 ligantes= polar
→H2O: 4 nuvens (2 pares + 2 e.q.) e 2 ligantes = polar
→HCl: 2 nuvens (2 eq) e 0 ligantes = polar

• Polaridade Da Molécula Apolar: Quando as moléculas ligadas ao centro são as mesmas, possuem a mesma eletronegatividade e, irão atrair os elétrons envolvidos na ligação com a mesma intensidade, havendo uma distribuição de cargas homogênea, sem formação de pólos. Ex: CH4; H2.
• As moléculas que têm distribuição de cargas homogêneas, podem ser polares, desde que tenham um número diferente de nuvens e ligantes. Ou seja, devem ter pelo menos um par de elétrons livres no centro da molécula.
→Ex: NH3; H2O
• Polaridade Da Molécula Polar: Se os elementos ligados ao átomo central forem diferentes, o átomo do elemento mais eletronegativo atrairá mais intensamente os elétrons da ligação para si, ficando, então, com uma carga parcial negativa, e o átomo menos eletronegativo com carga parcial positiva. Eles não precisam necessariamente ter um par de elétrons livres para serem polares.
→Ex: OCS; BF2Cl e HCl.
• Polaridade Da Ligação Apolar: Ligações apolares ocorrem entre átomos de um mesmo elemento químico.
→Ex: H2
• Polaridade Da Ligação Polar: Ligações polares ocorrem entre átomos de elementos químicos diferentes.
→Ex: HCl; BF
Interações Intermoleculares
• Ponte de Hidrogênio: Moléculas polares apenas quando tem H com FON (Flúor, Oxigênio e/ou Nitrogênio).
→Ex: H2O; NH3
→Interação mais forte de todas, gerando substâncias com elevado PE.
• Dipolo-Dipolo: Entre todas as outras moléculas polares;
→Ex: HCl; OCS; BF2Cl
→Tem força intermediária
• Van Der Waals: Entre todas as moléculas apolares
→É o tipo de interação mais fraco de todos, por isso gera substâncias com baixíssimas temperaturas de ebulição.

Ácidos
• Toda substância que em água produz o cátion H+ ou H3O+
• Ácido inorgânico com a presença de H no lado esquerdo da fórmula. (Exceto H2O).
• Sabor azedo; em geral, é tóxico e corrosivo.
• Conduzem eletricidade em solução aquosa.
• Reage com base formando sal e água (H2O).
• Possuem PH menor que 7.

• Ionização do ácido: Água rouba hidrogênio do oxigênio.
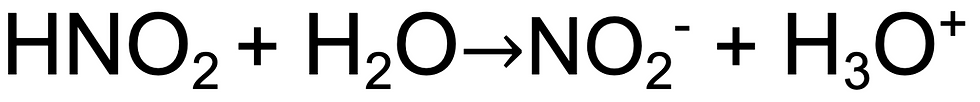
• Nomeando ácidos:

• Monoácido: contém apenas 1 hidrogênio ionizável
• Diácido: contém 2 hidrogênios ionizáveis
• Triácido: contém 3 hidrogênios ionizáveis
• Oxiácido: ácido que contém oxigênio
• Ternário: contém três elementos químicos diferentes
• Grau de Ionização:

→ɑ ≤ 5% = fraco
→5% < ɑ < 50% = semiforte
→ɑ ≥ 50% = forte

Bases
• Toda substância que em solução aquosa, sofre dissociação, liberando como único íon o ânion -OH.
→Ex: NaOH→Na+ + -OH
• Características:
→Uma base tem presença de um OH no lado direito da fórmula.
→Apresenta um sabor cáustico, lixívia ou adstringente.
→Conduzem corrente elétrica em solução (íons livres)
→Reagem com ácidos formando sal e água
→Possuem PH maior que 7
• Tipos de base:
→Monobase: OH
→Dibase: (OH)2
→Tribase: (OH)3
→Tetrabase: (OH)4
• Forças das Bases e Solubilidade:
→Bases fortes e solúveis: As que contém elementos da família 1A
→Fortes e parcialmente solúveis: As que contém elementos da família 2A
- Exceto Mg(OH)2 e Be(OH)2 pois são fracas e parcialmente solúveis da 2A
→Fracas e insolúveis: Todas as outras.
→Fraca e solúvel: NH4OH
• Carga
→1A: Li, Na, K, Rb, Cs, Fr (carga = +1)
→2A: Be, Mg, Ca, Sr, Ba, Ra (carga = +2)
→3A: Al (carga = +3)
• Nomenclatura de Bases
→Hidróxido de (elemento da família 1A, 2A ou 3A)
- Se for um metal de carga variável, como Ferro, deve-se escrever o número em algarismo romano. Ex: Hidróxido de ferro II = Fe (OH)2

Sais
• Toda substância que em água produz um cátion diferente de H+ e um ânion diferente de -OH e diferente dos óxidos.
• Integra reações vitais (respiração e fotossíntese)
• Composto obtido pela neutralização de um ácido por uma base.
→NaOH + HCl → H2O + NaCl (dissociando o cloreto de sódio = Na+ + Cl-)

• Nomenclatura: __________________________ de _____________
nome do elemento que era ácido nome da base

→ex: NaCl (Cloreto de sódio), Na2HPO4 (hidrogenofosfato de sódio).
Óxidos
• Toda substância formada por oxigênio e outro elemento. Só possui 2 elementos na sua fórmula química, sendo o oxigênio (carga -2) o elemento da direita.
→ex: H2O; SO3 ; CaO
Óxidos Ácidos
• Identificados pela presença de ametais (família 4A, 5A, 6A ou 7A)
• Reagem com água formando ácidos
• Reagem com bases formando sal e água.
• Nomenclatura: usando prefixos “di”, “tri”, “tetra”, “penta”, “hepta”...
→Heptóxido de dicloro = Cl2 O6; monóxido de carbono = CO
Óxidos Básicos
• Identificados pela presença de metais (1A, 2A, 3A)
• Reagem com água formando bases
• Reagem com ácidos formando sal e água.
• Nomenclatura: Óxido de …
→ex: Al2O3 = óxido de alumínio
Tipos de Reações
• Reação de Síntese: A + B→AB
• Reação de Análise/Composição: AB→A + B
• Reação de Troca/Deslocamento: AB + C→A + CB
• Reação de Dupla Troca: AB + CD→AD + CB
Fonte: CERICATO, Lauri. et al. Revisão Anual de Química - Módulo 1. São Paulo, SP: Editora FTD, 2018.





Comentários